![]() RESULTATS D'ANALYSE BACTERIOLOGIQUE :
RESULTATS D'ANALYSE BACTERIOLOGIQUE :
Les prélèvements d'eau ont été réalisés le 24 mai 2000 en trois endroits (Ruisseau 1, ruisseau 2 et l'étang) et les analyses ont été effectuées le 25/ 05/2000.
|
ENDROITS |
ANALYSES |
RESULTATS |
VALEURS LIMITES |
|
RUISSEAU I (en provenance des bois). |
Coliformes totaux |
46 |
500/ 10000 / 100 ml. |
|
Coliformes fécaux |
0 |
1000/ 2000 / 100 ml |
|
|
Streptocoques fécaux |
21 |
100 / 100 ml. |
|
|
RUISSEAU II (traversant des prairies). |
Coliformes totaux |
530 |
500/ 10000 / 100 ml. |
|
Coliformes fécaux |
27 |
1000/ 2000 / 100 ml |
|
|
Streptocoques fécaux |
300 |
100 / 100 ml. |
|
|
ETANG |
Coliformes totaux |
110 |
500/ 10000 / 100 ml. |
|
Coliformes fécaux |
7 |
1000/ 2000 / 100 ml |
|
|
Streptocoques fécaux |
1 |
100 / 100 ml. |
Ces analyses ont été effectuées par l'Institut E. MALVOZ , Quai du Barbou , 4. 4020 LIEGE
L'analyse du ruisseau II révèle un taux élevé en coliformes totaux et streptocoques fécaux dû probablement à une contamination anthropologique ou animale (lisier ?, excréments d'animaux ?).
![]()
![]() BIOLOGIE : analyse bactériologique
d'échantillons d'eau.
BIOLOGIE : analyse bactériologique
d'échantillons d'eau.
1. Objectif :
Dans ce genre de recherches, il est fréquent que le nombre de bact"ries soit tellement élevé qu'il est impossible de réaliser un comptage. Dès lors, il faut utiliser une dilution de l'échantillon 10x, 100x ou plus. Dans un premier temps, nous allons examiner si le comptage est possible sans dilution de nos échantillons.
2. Plan des prises d'échantillons :
A. Petit ruisseau
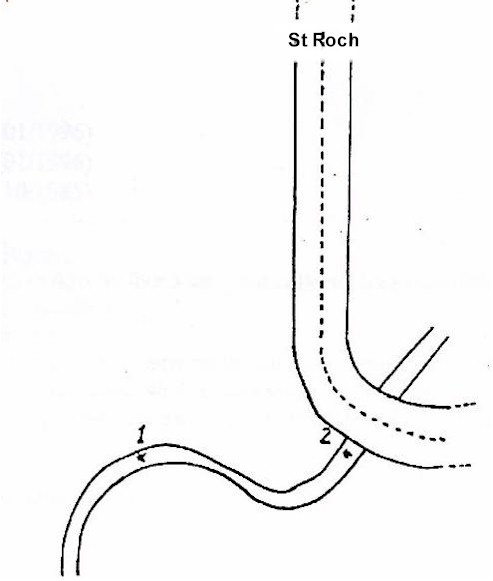
B. Piscine

C. Petit étang
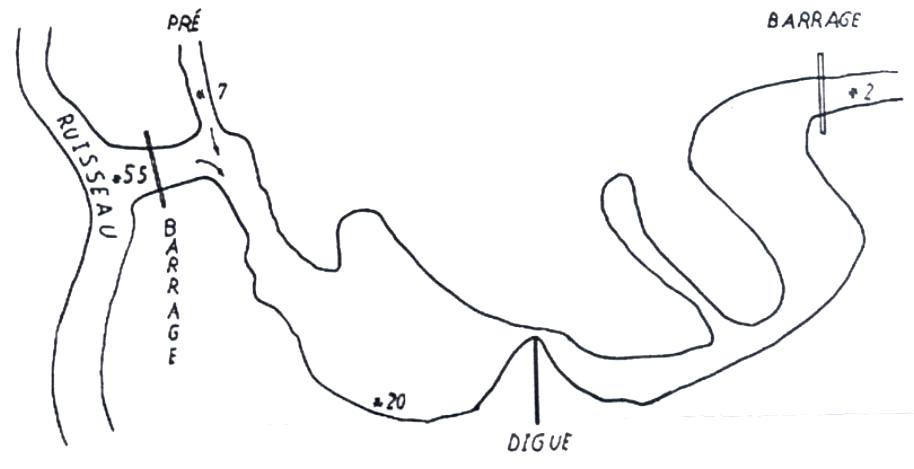
3. Méthode utilisée :
A. Références
:
![]() -XP T 90-401 (01/1996)
-XP T 90-401 (01/1996)
![]() -XP T 90-402 (01/1996)
-XP T 90-402 (01/1996)
![]() -NF T 90-414(10/1985)
-NF T 90-414(10/1985)
B. Instruments employés
:
![]() - Bouteilles, stérélisées
dans un four à sec, pour collecter les échantillons
- Bouteilles, stérélisées
dans un four à sec, pour collecter les échantillons
![]() - Eprouvette de 25 ml stérilisée
- Eprouvette de 25 ml stérilisée
![]() - Pipette d'1 ml stérilisée
- Pipette d'1 ml stérilisée
![]() - Boîtes à Pétri
(une vide et une contenant un milieu de culture préparé)
- Boîtes à Pétri
(une vide et une contenant un milieu de culture préparé)
![]() - Milieux de culture : - en
fusion (46° C et sans sélection de germes)
- Milieux de culture : - en
fusion (46° C et sans sélection de germes)
![]() - préparé pour
mettre en évidence les germes fécaux
- préparé pour
mettre en évidence les germes fécaux
![]() - Incubateur (37°C)
- Incubateur (37°C)
![]() - Pompe à vide
- Pompe à vide
![]() - Membrane pour la pompe à
vide.
- Membrane pour la pompe à
vide.
C. Technique :
![]() - Récolte d'échantillons
: nous avons utilisé des bouteilles, stérilisées
- Récolte d'échantillons
: nous avons utilisé des bouteilles, stérilisées
![]() préalablement dans un
four à sec, que nos avons plongées dans l'eau à
préalablement dans un
four à sec, que nos avons plongées dans l'eau à
![]() l'endroit précisé
pour chaque groupe par M. Remacle.
l'endroit précisé
pour chaque groupe par M. Remacle.
![]() - Mise en culture : pour faire
les culures de bactéries, nous nous sommes
- Mise en culture : pour faire
les culures de bactéries, nous nous sommes
![]() servis de deux milieux différents
:
servis de deux milieux différents
:
|
1°
|
Un milieu de culure en fusion stocké à 46° C. Nous en avons transféré 15 ml dans des boîtes à Pétri que nous avons légèrement agité de manière à ce que la surface du milieu soit bien lisse pour éviter une mauvaise répartition de l'échantillon lorsqu'il sera placéde dedans. Nous avons ensuite prélevé 1 ml de notre échantillon d'eau dans une pipette stérile. Il a été versé précautionneusement dans les boîtes à Pétri contenant le milieu en fusion, il ne s'agit pas de faire des projections de l'échantillon (ce qui risquerait de créer des imprécisiions dans les résultats puisque les gouttelettes capteraient plus facilement les bactéries contenues dans l'air ou bien des germes venant de la personne qui souffle dans la pipette pour propulser le reste de l'échantillon). |
| 2° | Nous avons aussi utilisé un milieu préparé pour mettre en évidence les germes fécaux. Pour mener à bien cette culture, nous avons eu recours à l'utilisation d'une pompe à vide. Nous avons placé une membrane à l'encolure d'un entonnoir en métal qui va recevoir l("chantillon d'eau. L'échantillon passera à travers la membrane lorque le vide sera fait, ainsi il va être libéré de ses bactéries et réclté dans un vase pour connaître la quantité d'eau de départ. La membrane contenant maintenant toutes les bactéries va être placée avec précaution sur le milieu préparé. Il faut éviter de faire des plis lors de la pose de la membrane sur le milieu. Il ne faut pas que la pince utilisée pour le transport de la membrane depuis la pompe à vide jusqu'au milieu ne touche celui-ci et lm'endommage par la même occasion |
![]() - Développement : les
boîtes de Pétri contenant les milieux sont placées
- Développement : les
boîtes de Pétri contenant les milieux sont placées
![]() dans un incubateur à
37 °C (température du corps humain et à laquelle les
dans un incubateur à
37 °C (température du corps humain et à laquelle les
![]() bactéries sont sensées
être habituées puisque c'est leur abri préféré
pour
bactéries sont sensées
être habituées puisque c'est leur abri préféré
pour
![]() un développement optimal)
pendant à peu près 4 jours. On va ensuite
un développement optimal)
pendant à peu près 4 jours. On va ensuite
![]() essayer d'interpréter
les résultats (une tache sur le milieu = une coloniede
essayer d'interpréter
les résultats (une tache sur le milieu = une coloniede
![]() bactéries).
bactéries).
N.B. : tous les instruments ont été stérilisés dans un four à sec.
A. Bruts sans distillation :
| a) Etang : | ||
| N° 2 : | milieu membrane : INCOMPTABLE milieu coulé : INCOMPTABLE |
|
| N° 7 : | milieu membrane : INCOMPTABLE milieu coulé : INCOMPTABLE |
|
| N° 20 : | milieu membrane : INCOMPTABLE milieu coulé : INCOMPTABLE |
|
| N° 55 : | milieu membrane : INCOMPTABLE milieu coulé : INCOMPTABLE |
|
| b) Ruisseau : | ||
| N° 1 : | milieu membrane : INCOMPTABLE milieu coulé : INCOMPTABLE |
|
| N° 2 : | milieu membrane : INCOMPTABLE milieu coulé : INCOMPTABLE |
|
| c) Piscine | ||
| milieu préparé
: 16 bactéries/455 ml = 35.2 germes fécaux /litre milieu coulé : 3 bactéries/1ml = 3000 germes /litre |
||
5. Conclusion :
Avec le retour du printemps, la chaleur favorise la prolifaration bactérienne. Tout ce travail sera recommencé avec une dilution 10x.
![]()
